TMT/TMTproラベリングと相補的なレポーターイオンクラスター
先日ユーザーから、TMTproラベルの相補的イオン(complementary ions)についてのサポート依頼がありました。相補的イオンは、プリカーサーがレポーターイオンと一酸化炭素を失い、ペプチドとラベルのバランス領域を残してフラグメンテーションする際に形成されます。相補的イオンの(同位体ピークの)間隔はレポーターイオンと同様ですが、質量はペプチドの質量によって変化します。依頼ユーザーは相補的イオンのピークがペプチドのマッチングスコアに影響を及ぼすことを懸念されていました。
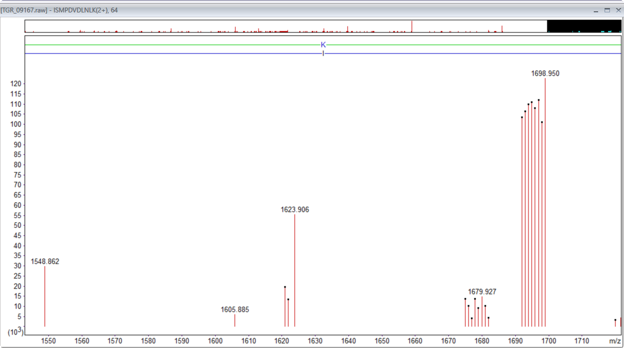
図1:ペプチドISMPDVNLNLK, m/z 926.546, 2+, Mr(測定値) 1851.0775 のTMTpro相補的イオン(1価)の例。さらに水分子分(-18Da)の消失に対応する、よりピーク強度が低いクラスターも存在します。
懸念について検証するため、スペクトルを処理し相補的イオンを除去してMASCOTのペプチドスコアに変化があるかどうかを確認するスクリプトを作成し、除去前後の結果を比較しました。ユーザーからお借りしたデータセットでは、全体のうち約15%のペプチドが影響を受けていました。TMTproの相補的イオンのピークを除去した後、影響を受けたペプチドのスコアは平均で3-4増加しました。一方ごく一部の少数のペプチド(124)については、相補的なイオン領域の除去後にスコアが下がりました。これらのペプチドは相補的イオンの1つをペプチドのフラグメントイオンと誤認しているか、相補的イオンと同じ領域に実際のフラグメントイオンがありそれが除去されたかのどちらかのケースでした。
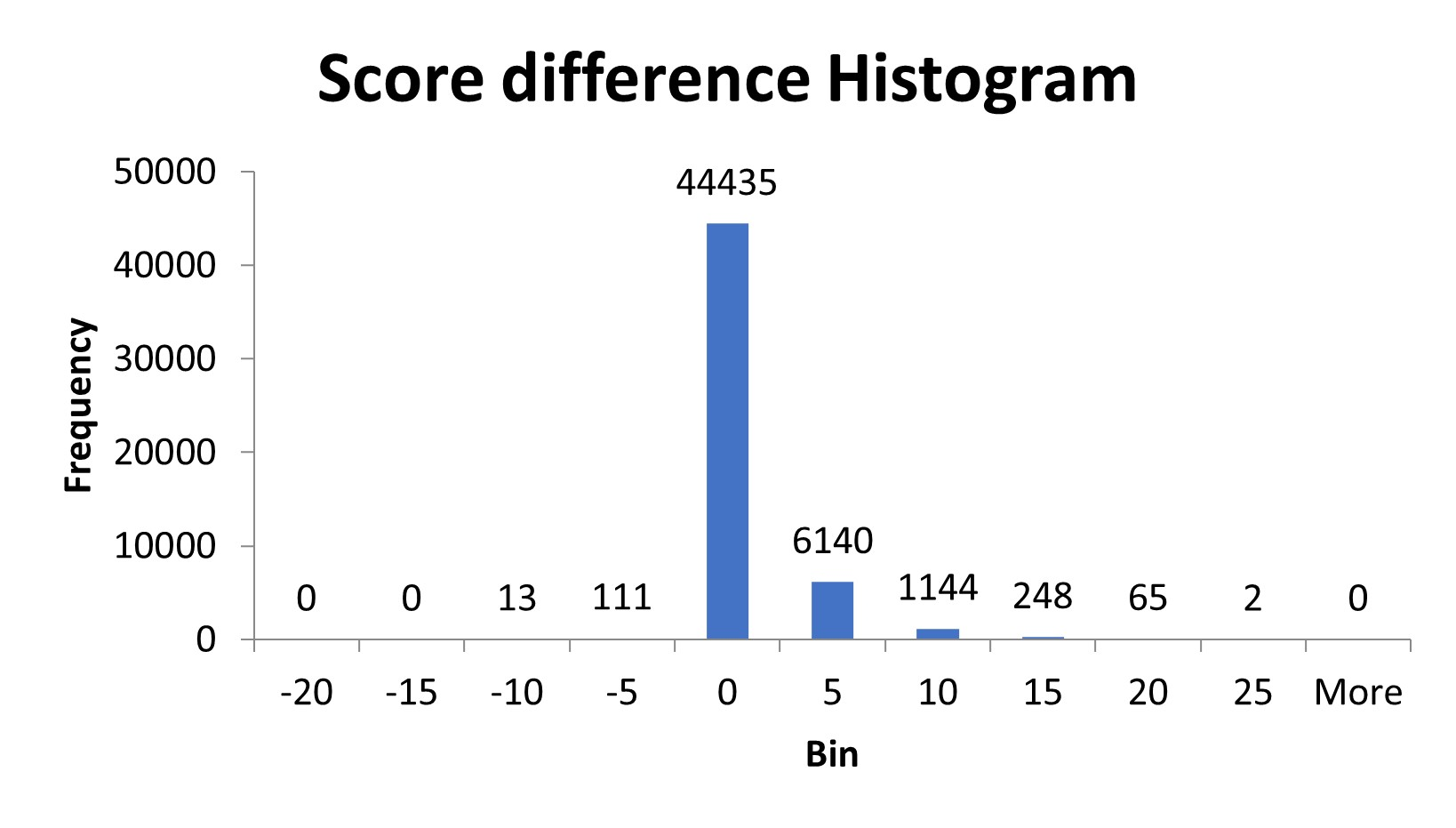
図2:スペクトルから相補的イオンピークを除去した後のペプチドスコアの差のヒストグラム
次にこの相補的イオンを除去するのではなく、定量解析に利用する事を検討しました。相補的イオンの発生は、フラグメンテーションのエネルギーに依存します。ペプチドからラベルのバランサー部分を切り離し、ペプチドを完全に断片化するのに十分なエネルギーを加える事で、相補的なイオンが存在しないようにすることが最も理想的と言えます。それが難しいなら代わりの方法として、逆に相補的なイオンの生成を促進する方法を設定することも可能です。Wührら1やSonnettら2は、TMTの相補的イオンを定量解析に利用できることを示しました。またJohnsonらによる最近の論文3ではこの方法をTMTproラベルにも拡張し、TMTproCと名付けました。
相補的イオンを定量解析に使用する事を検討する主な理由は、標準レポーターイオン領域で生じる干渉作用です。共分離イオンの影響により、標準レポーターイオンの測定値が歪んでしまう可能性があるためです。この解析ではレポーター部分より相補的イオンの方が質量が大きく、TMTやTMTpro試薬において利用されているCとNの同位体の区別が困難となります。そのため今回は利用しませんでしたが、それでもTMTでは5チャンネル、TMTproでは8チャンネルを解析に利用することが可能です。
解析データを見ると、三価で質量が大きめのペプチドの多くで、二価の相補的イオンのピークが見られることがわかりました。
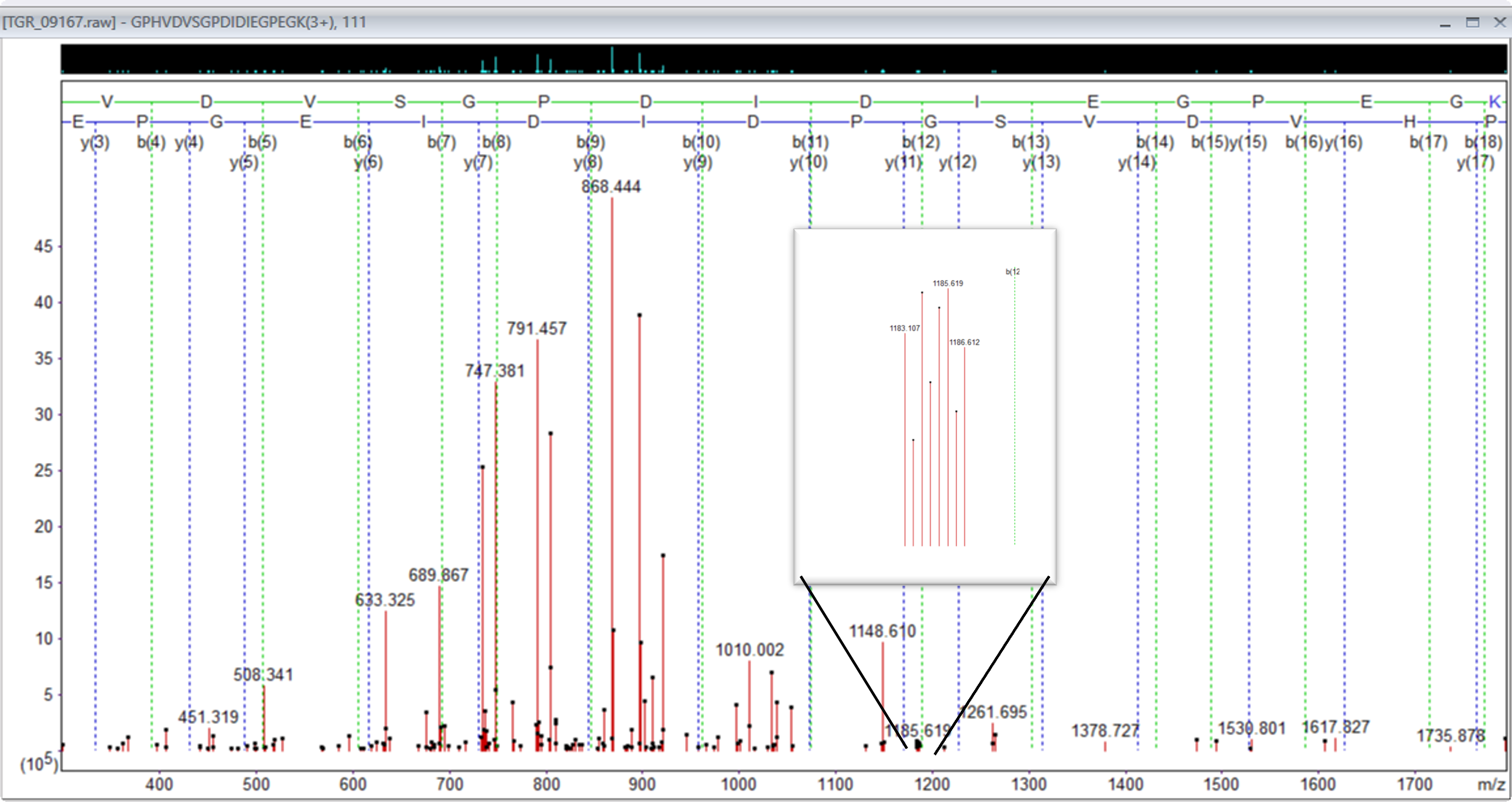
図3:プリカーサー842.781280,3+のデータと、その中に含まれる2価相補的イオン[m/zの範囲1183から1186]のピークの拡大図。
作成したピーク除去スクリプトの機能を拡張し、検索と定量の前に元のレポーター領域の情報を消し、相補的イオン質量をレポーターイオン質量に変換できるようにしました。相補的なイオン領域は1価または2価の電荷を有しますが、スペクトルのどこに出るのかについてはプリカーサーの質量並びにレポーターイオン領域のデータから計算します。スペクトルは1価または2価の電荷に帯電した相補的イオンのみを含む傾向にありますが、そのうちピークの多い方の領域を採用してレポーターイオンへの変換を行いました。このように変換したデータを、Mascot Serverが以前から有する定量解析手法に適用する事で定量解析を行う事ができました。
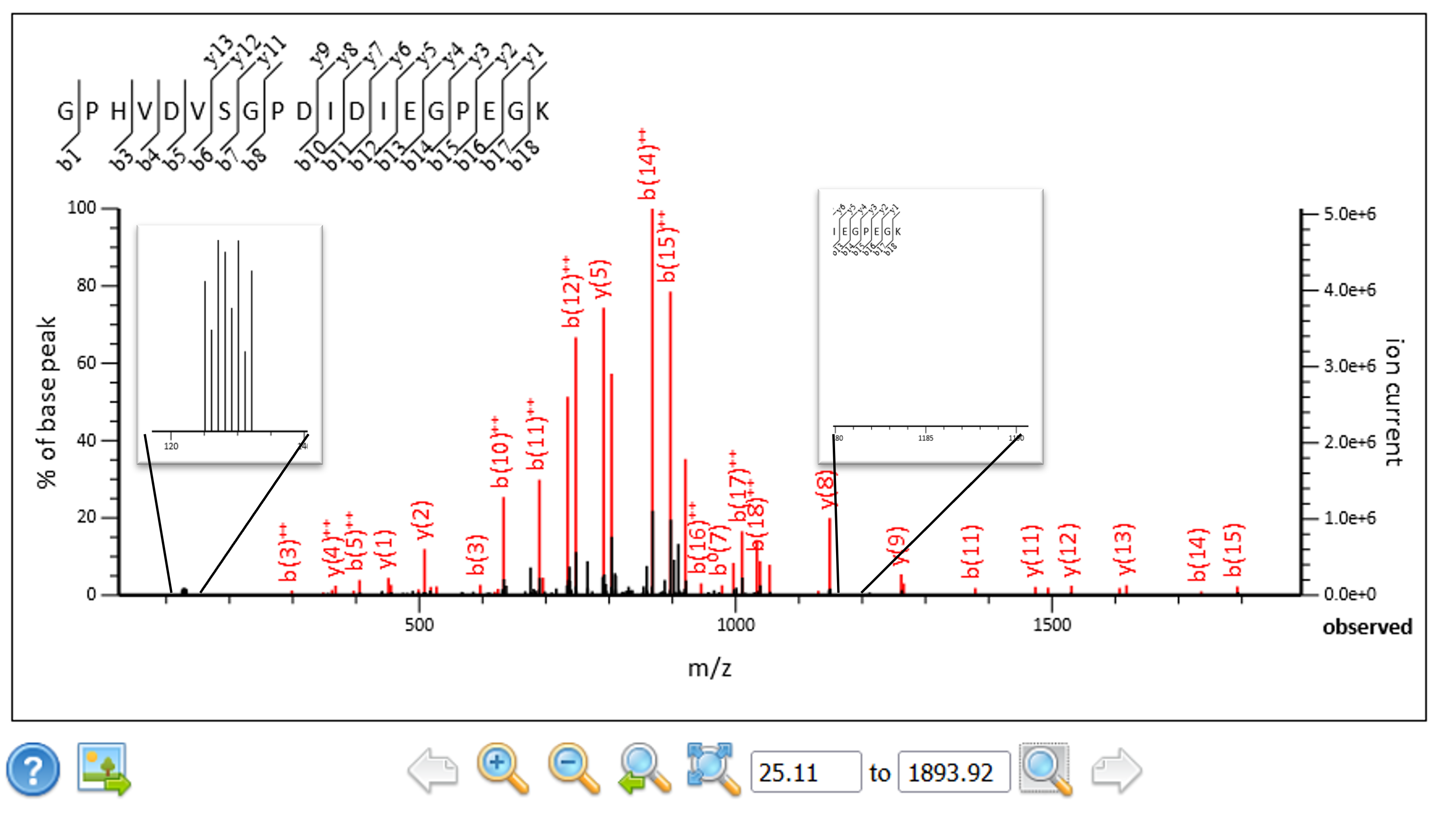
図4:相補的なイオンを元の位置から抽出し、レポーターイオン領域と入れ替えたスペクトルデータ。
Johnsonら3の発表論文では、24ファイルからなる分画データセットをTMTproCの手法で定量解析しています。このデータは、8チャンネルのヒト細胞溶解液をすべて1:1:1:1:1:1:1:1の濃度で、酵母細胞溶解液を0:1:5:10: 10:5:1:0濃度で混合したサンプルのデータです。そして、この2つのサンプルをHuman:Yeast が10:1 の割合で混合します。この実験デザインの目的は、変化のないヒトタンパク質のバックグラウンドに、ひとに比べ比率が小さいながらも大きな変化を持つ酵母のサンプルを用意することです。実験では酵母サンプルの比を評価し、ヒトサンプルからの影響度も検証しています。Johnsonら3の発表論文では、データを分画せず従来のMS2レポーターイオン定量、MS3レポーターイオン、TMTproC定量の比較も行っています。今回私たちが追試的に行った解析では、24の分画ファイルのデータセットについて、論文と同じ方法で定量結果を評価しました。以下の表は、TMTproCの解析に使用したラベルと変換後の相補的イオンについて、サンプルとの関係性を表しています。
| Label | Human | Transformed mass |
Yeast |
|---|---|---|---|
| 126 | 1 | 133 | |
| 127C | 133 | ||
| 127N | 132 | ||
| 128N | 132 | ||
| 128C | 1 | 132 | 1 |
| 129N | 1 | 131 | 5 |
| 129C | 131 | ||
| 130N | 130 | ||
| 130C | 1 | 130 | 10 |
| 131N | 1 | 129 | 10 |
| 131C | 1 | 128 | 5 |
| 132N | 127 | ||
| 132C | 127 | ||
| 133C | 1 | 127 | 1 |
| 133N | 126 | ||
| 134N | 1 | 126 |
データベース検索により、1% FDRで31.7万のPSMsから酵母タンパク質にマッチする37,600のペプチドが発見されました。MASCOT Distillerでは定量計算に使用するかどうかを判断する、Precursor同位体クラスターピークの質を評価するパラメーターとその閾値がありますが、今回の解析ではそれ以外の追加的なフィルタリングは行っていません。酵母のセットの比に着目した解析ですが、ヒトと酵母の両方のメンバーを含むタンパク質ファミリーのペプチドも解析対象に含めています。図5のヒストグラムは5:1、10:1、10:5の各サンプルにおいてペプチドが実際にどのような比を示したかという値を元に書いたヒストグラムです。ヒトペプチドの影響により目標値を中心に少し広がった分布になったものの、概ね期待される比率に近かったことがわかります。ヒトと酵母のタンパク質が混在する同定タンパク質ファミリー由来のペプチドを除外する事でヒストグラムはより改善されるかもしれませんが、今回の解析でそれを実施するのは難しいです。
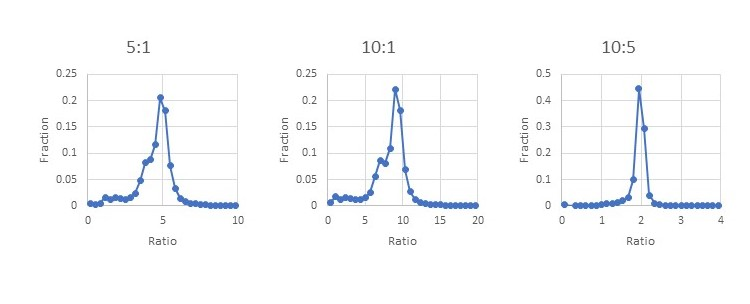
図5:24分画データセットTMTProC解析における、ペプチドの比率の分布。
本記事の結論です。TMT/TMTproの測定で不要な相補的イオンが発生する場合、検索前にそれらを除去する事でペプチドのスコアリングが若干有利となります。また相補的イオン部分をレポーターイオンのデータに変換し、Mascot ServerでもTMTcやTMTproCのプロトコルで測定されたデータの定量解析を行うことができます。この記事で紹介したスクリプト、TMT_complementary_ions.plは、ヘルプページからダウンロードすることができます。ヘルプページではMascot Daemonで自動的に処理させる方法に関する方法も記されています。TMTproC定量メソッドのオリジナルの方にはない、二価の相補的イオンを使用するためのオプションもスクリプトには追加されています。
今回のような中間スクリプトを使用する事なくソフトウェア側で相補的イオン定量解析に対応できるようにするため、将来的にはMascot Distillerでその機能を追加実装する予定です。
参考文献
1 Wühr M, Haas W, McAlister GC, et al. Accurate multiplexed proteomics at the MS2 level using the complement reporter ion cluster. Anal Chem. 2012;84(21):9214-9221. DOI: 10.1021/ac301962s
2 Sonnett M, Yeung E, Wühr M. Accurate, Sensitive, and Precise Multiplexed Proteomics using the Complement Reporter Ion Cluster. Anal Chem. 2018; 90(8):5032-5039. DOI: 10.1021/acs.analchem.7b04713
3 Johnson A, Stadlmeier, M, Wühr M. TMTPro Complementary Ion Quantification Increases Plexing and Sensitivity for Accurate Multiplexed Proteomics at the MS2 Level. J. Proteome Res. 2021; 20(6):3043–3052. DOI: 10.1021/acs.jproteome.0c00813
Keywords: Mascot Daemon, Mascot Distiller, quantitation, reporter, scoring, TMT