|
Molecular Stressors Engender Protein Connectivity Dysfunction through Aberrant N-Glycosylation of a Chaperone
Pengrong Yan, Hardik J. Patel, Sahil Sharma, Adriana Corben, Tai Wang, Palak Panchal, Chenghua Yang, Weilin Sun, Thais L. Araujo, Anna Rodina, Suhasini Joshi, Kenneth Robzyk, Srinivasa Gandu, Julie R. White, Elisa de Stanchina, Shanu Modi, Yelena Y. Janjigian, Elizabeth G. Hill, Bei Liu, Hediye Erdjument-Bromage, Thomas A. Neubert, Nanette L.S. Que, Zihai Li, Daniel T. Gewirth, Tony Taldone, and Gabriela Chiosis
Cell Reports 31(13), 107840, (June 30, 2020)
この研究論文では、様々な実験手法を用いてシャペロンタンパク質GRP94のストレス誘発性N-グリコシル化が引き起こす構造的および機能的変化を調べています。
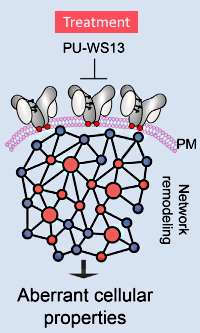
用いられた実験手法は多岐に渡ります。非変性およびSDS-PAGE、siRNAノックダウン、酵素的脱グリコシル化、CRISPR/Cas9を使用した変異体作成およびノックアウト、フローサイトメトリーによる細胞生存率、PK/PD/毒性試験、およびLC-MS/MSを用いたN-グリコシル化部位の同定など。これらの実験結果から、N-グリコシル化がシャペロンであるGRP94をフォールディングタンパク質から足場タンパク質へと導く事を実証しました。
この特異的なN-グリコシル化の増加は、細胞膜での腫瘍性タンパク質(oncogeneから発現されたタンパク質)との安定した相互作用が可能な立体構造の状態を維持するように促します。著者らはまた、低分子プリン化合物を用いてこの異常な形態の形成を選択的に抑制できることを示し、今後治療に応用できる可能性を示しました。
|
 |